Принципы проточного центрифугирования
Mel Dorin, Judy Cummings | Beckman Coulter, Inc.
Преимущества проточного центрифугирования
Чтобы осадить материал в обычном центрифужном роторе, необходимо выполнить следующие шаги:
- Загрузить образец в ротор;
- Разогнать центрифугу до рабочей скорости;
- Центрифугировать образец определенный промежуток времени;
- Остановить ротор;
- Извлечь образец.
Эти шаги следует повторять до полной обработки всего образца. Если его много, скорость осаждения низкая, время разгона/торможения ротора долгое, а емкость ротора маленькая, то процесс центрифугирования будет трудоемким и время затратным.
Проточное центрифугирование экономит время работы оператора, исключая необходимость постоянно заполнять и опорожнять многочисленные центрифужные бутыли, а также запускать и останавливать процесс.
Например, в зависимости от выбранного ротора, 10 л образца, содержащего частицы с коэффициентом седиментации 500 S можно осадить методом проточного центрифугирования за 4 часа или даже быстрее. Тогда как обычное центрифугирование с загрузкой нескольких партий образца потребует 12-21 час.
Такая комбинация высокого центробежного ускорения и высокой производительности позволяют использовать проточное центрифугирование для масштабного сбора вирусов (как в исследовательских целях, так и для коммерческого производства вакцин), осаждения бактерий и субклеточных фракций.
Кроме того, применение проточного центрифугирования не ограничивается биомедицинскими приложениями. Его можно иметь в виду в тех случаях, когда необходимо выделить частицы любого типа с коэффициентом седиментации 50 S и выше из жидкости объемом 2 л и больше.
Примечание: Коэффициент седиментации обычно выражается в сведбергах (S), где 1 S = 1·10-13 секунд. Таким образом, если коэффициент седиментации частицы равен 500·10-13 секунд, то говорят, что он имеет значение 500 S. Коэффициент седиментации s выражается формулой s = v / ω2r , где v – скорость седиментации частиц (см/с), ω – угловая скорость вращения ротора (рад/c), r – расстояние от оси вращения (см). Определяемый таким образом коэффициент седиментации sobs зависит от растворителя и температуры, в отличие от коэффициента седиментации s20,w, который определяется для частиц в воде при 20°C.
Роторы для проточного центрифугирования существенно ускоряют осаждение материала по двум причинам:
- В них длина пути осаждения частиц меньше, чем в угловых роторах, что приводит к уменьшению времени центрифугирования. Поэтому твердые частицы, присутствующие в потоке, эффективно осаждаются на стенки ротора, а супернатант с пониженным содержанием частиц вытекает из ротора.
- Большая вместимость, которая исключает необходимость запускать и останавливать центрифугу так же часто, как в случае углового ротора. Это позволяет ускорить процесс за счет сокращения времени на загрузку и извлечение образца между запусками центрифуги и на разгон/торможение ротора.
Образцы для проточного центрифугирования
Роторы для проточного центрифугирования имеют значительные преимущества перед обычными роторами в тех случаях, когда образец имеет следующие свойства:
- Коэффициент седиментации частиц, которые необходимо собрать, не меньше 50 S. Роторы для проточного центрифугирования имеют высокую эффективность осаждения и позволяют выделить твердый материал из жидкой среды быстрее, чем бакетные и угловые роторы.
- Отношение количества твердых частиц к жидкости невелико (5-15%). При отношении выше 15% ротор будет слишком эффективным, то есть осадок будет образовываться настолько быстро, что ротор будет мгновенно наполняться. А это означает, что его надо будет останавливать и извлекать образец настолько часто, что будет теряться слишком много времени на разгон/торможение и очистку ротора между запусками центрифуги.
Процесс проточного центрифугирования
Проточное центрифугирование осуществляют с помощью роторов CF-32 Ti и JCF-Z компании Beckman Coulter Life Sciences. В ходе вращения ротора при выбранной рабочей скорости через него постоянно прокачивается образец. Частицы, содержащиеся в образце, осаждаются на стенки ротора, а осветленный эффлюент вытекает из ротора. Этот процесс продолжается до тех пор, пока не закончится исходный материал (образец) или не будет исчерпана способность ротора удерживать частицы.
Таким образом, количество материала, которое можно загрузить для одного цикла центрифугирования, определяется его объемом и концентрацией частиц. По окончании проточного центрифугирования можно собрать осадок и/или обедненный эффлюент, также как после дифференциального центрифугирования в обычном угловом или бакетном роторе можно собрать осадок и/или супернатант.
Роторы CF-32Ti и JCF-Z состоят из корпуса, вставляемого в него сердечника и крышки (рис. 1). Поток жидкости протекает через сердечник по радиальным каналам. В сердечник вставляются 4 перегородки, через каналы которых происходит загрузка и в некоторых случаях разгрузка ротора.
Важным элементом для осуществления проточного центрифугирования является вращающийся уплотнительный узел, который позволяет трубкам, по которым в ротор поступает жидкость, оставаться подсоединенными во время работы. Уплотнительные элементы предотвращают контакт образца с окружающей средой, что минимизирует возможность его контаминации. Переключая направление потока жидкости в трубках, можно легко перейти из режима загрузки на режим разгрузки ротора.
Подготовка ротора к центрифугированию осуществляется во время вращения при малых скоростях. Буферный раствор, подушка жидкости или слои раствора для формирования градиента, например сахарозы, закачивают через выходную трубку.
Затем ротор разгоняют до рабочей скорости и через центральный вход уплотнительного узла при помощи того же насоса закачивают суспензию. По каналам сердечника она достигает дна корпуса. Движение в таком вертикальном герметизированном канале практически исключает нежелательное пенообразование (рис. 2).
По мере того, как жидкость движется вверх вдоль скоса сердечника, происходит осаждение частиц по направлению к стенкам корпуса. Образующийся обедненный эффлюент движется по верхнему радиальному каналу и покидает ротор через выходную трубку уплотнительного узла.
Методы разделения проточным центрифугированием
Концентрировать частицы с помощью проточного центрифугирования можно тремя способами: осаждая их на стенки ротора, на подушку плотной жидкости, например сахарозы, или разделяя в градиенте плотности. Первые два метода наиболее часто используются для сбора частиц или повторного центрифугирования обеденного эффлюента. В случае, когда необходимо отделить частицы от примесей различных плотностей, разделение в градиенте плотности позволит получить наилучший результат.
Осаждение и осветление
Осаждение подходит для частиц, которые не могут быть повреждены при вдавливании в стенки ротора. Это самый быстрый метод проточного центрифугирования, который позволяет обработать большие объемы исходного материала.
При малых скоростях ротор заполняется буферным раствором или исходным материалом. Затем его разгоняют до выбранной рабочей скорости и через центральный канал уплотнительного узла закачивают исходный материал.
Процесс продолжается до тех пор, пока не закончится образец или пока не будет исчерпана способность ротора удерживать частицы. (Наступление второго условия легко определить – вытекающий из ротора эффлюент становится мутным.) Ротор вращается при рабочей скорости промежуток времени, необходимый для того, чтобы все частицы достигли стенок ротора, в то время как через центральный канал прокачивается раствор буфера или воды. Затем ротор постепенно останавливают, супернатант, оставшийся в роторе, сливают, а осадок соскребают со стенок.
Иногда проточное центрифугирование проводят в 2 этапа. Сначала материал осветляют, путем удаления крупных частиц при малой скорости вращения. На втором этапе получившийся эффлюент прокачивают через ротор, вращающийся на высокой скорости, собирая маленькие частицы. Таким образом, например, можно осветлять вирусосодержащие культуральные среды, осаждая клеточный дебрис. Осветленный эффлюент можно повторно центрифугировать для осаждения или разделения вирусных частиц.
Осаждение на жидкостную подушку
Частицы, которые теряют биологическую активность при осаждении на стенки ротора (например, некоторые вирусы), можно осаждать на подушку плотного раствора, такого как раствор сахарозы. Этот метод следует использовать в любом случае, когда кажется более целесообразным собирать частицы из раствора, нежели соскребать их со стенки ротора. Разумеется, в таком случае емкость ротора для частиц понижена из-за присутствия жидкостной подушки.
При таком способе центрифугирования загрузка ротора происходит во время вращения при малых скоростях (рис. 3). Сначала через выходную трубку поверх перегородок сверху сердечника в него закачивается буфер или вода. Затем таким же способом в ротор закачивают жидкостную подушку (например, 60% раствор сахарозы). Центробежные силы прижимают ее к стенке, и она размещается по периферии, поскольку имеет большую плотность, чем вода или буфер.
Во время разгона ротора до рабочей скорости через центральный канал прокачивают раствор буфера. При достижении рабочей скорости через центральный канал начинают закачивать образец.
По окончании осаждения разгрузку ротора (так же, как и загрузку) осуществляют на низких скоростях. Через выходную трубку в ротор закачивают воздух, который блокирует радиальные каналы, как показано на рис. 4. (Это предотвращает перемещение жидкости по этим каналам и разрушение подушки, нагруженной частицами, во время процесса разгрузки). Затем через выходную трубку поверх перегородок в ротор закачивают плотный раствор, что заставляет содержимое ротора вытекать наружу через центральный канал.
Этот метод чаще всего используют для очистки вирусов. Поскольку в роторах для проточного центрифугирования частицы имеют короткую длину пробега (около 10 мм), нет нужды использовать линейный градиент. Во время загрузки и ускорения ротора ступенчатый градиент в достаточной степени диффундирует до линейного.
Как правило, раствор для формирования градиента, например раствор сахарозы, используют в 2 или 3 разных концентрациях, которые зависят от плотности разделяемых частиц. Последний самый плотный раствор выполняет роль подушки, предотвращающей осаждение на стенки ротора. Короткая длина пробега позволяет разделять частицы достаточно быстро. Однако возможность полностью разделить и собрать несколько полос в таком узком градиенте зависит от плавучей плотности частиц.
Последовательность действий для разделения в градиенте похожа на последовательность действий при осаждении на подушку. Во время вращения ротора на низкой скорости через выходную трубку в него закачиваются жидкости в следующей последовательности: буфер или вода, ступенчатый градиент (сначала самый легкий раствор), подушка.
Оставшаяся часть протокола совпадает с аналогичной частью протокола, описанной в предыдущем разделе. В данном случае, однако, центрифугирование следует выполнять настолько долго, насколько это нужно для разделения частиц.
Выбор скорости потока
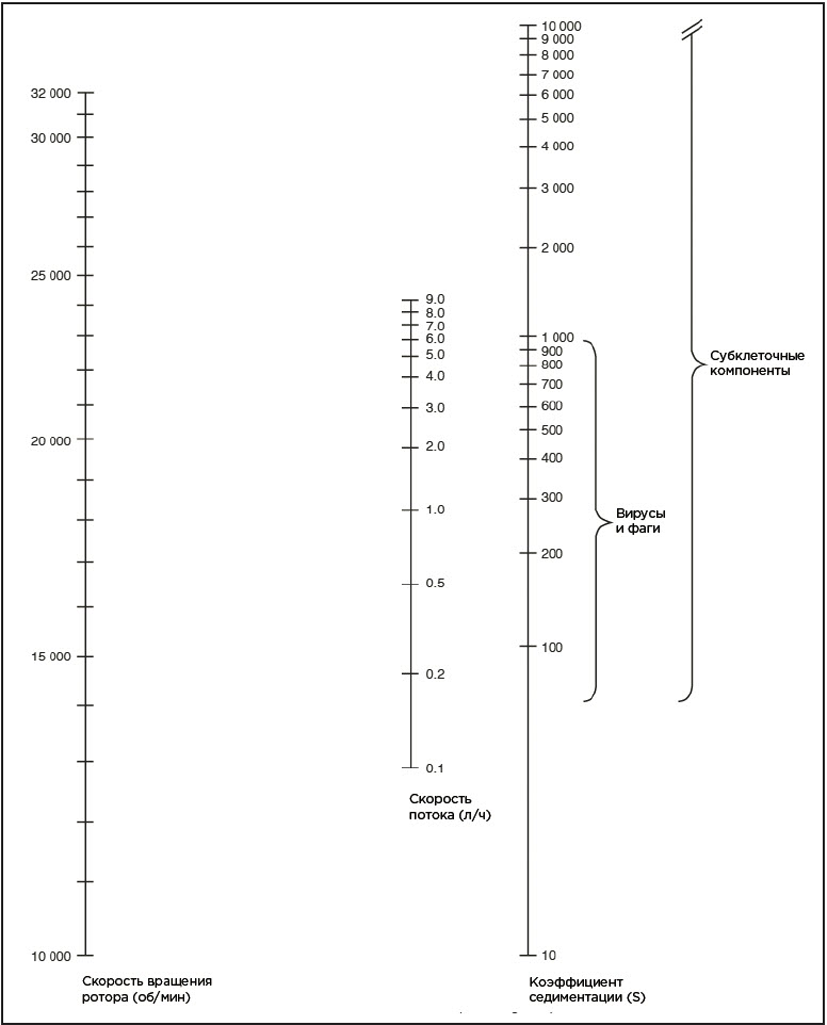
Cкорости потока и вращения ротора определяет коэффициент седиментации собираемых частиц. Маленькие частицы требуют либо приложения больших центробежных сил, либо более длительного осаждения по сравнению с большими частицами.
Перед центрифугированием необходимо определить рабочую скорость вращения, при которой центробежная сила будет достаточно высока, чтобы осадить интересующие частицы, и скорость потока, при которой частицы успеют осесть до его выхода из ротора.
Для наивысшей эффективности центрифугирования стараются устанавливать скорость потока предельно близкую к теоретическому максимуму. (Номограммы зависимости между теоретическим максимумом скорости потока и скорости вращения ротора для частиц с известными коэффициентами седиментации представлены ниже).
Метод A
Следующее уравнение позволяет определить примерную скорость потока F или скорость вращения ротора для определенных образцов и построить номограммы.

Скорость потока F выражается в мл/мин. Стандартный сердечник для ротора JCF-Z имеет rt = 7,6 см, rb = 7,1 см, соответственно ri = 7,35 см, а уравнение (1) можно преобразовать в уравнение (2a):


Примечание: представленные выше уравнения справедливы при условии, что плотность и вязкость жидкости, в которой суспендированы частицы, примерно равны плотности и вязкости воды при 20°С. В противном случае следует привести коэффициент седиментации sr в соответствие с характеристиками жидкости.
Перед использованием номограммы и уравнений (2) следует рассчитать коэффициент седиментации sr. Если диаметр D частиц известен, то

Если известен коэффициент седиментации s20,w, то:

Метод B
Легко определить скорость потока в роторах для проточного центрифугирования, зная скорость осаждения в другом роторе и k-факторы обоих роторов. K-фактор – это характеристика ротора, которая определяет эффективность осаждения. Его можно посчитать, используя уравнение:

Предположим, центрифугирование было выполнено при помощи ротора JA-10. Время осаждения при полной загрузке на максимальной скорости составило 5 минут. Эту информацию можно использовать для определения времени осаждения в роторе JCF-Z, применив соотношение:

Подставляя в это уравнение экспериментально определенные значения переменных:

определяем, что время осаждения в роторе JCF-Z t2=24 секунды. Если объем ротора JCF-Z составляет 1 л, это значит, что мы можем осадить жидкость объемом 1 л за 24 секунды. Следовательно, мы можем использовать скорость потока 41 мл/с (2,4 л/мин). Если отношение количества твердых частиц к жидкости составляет 2%, мы можем отцентрифугировать 50 л образца (за 21 мин) перед тем как потребуется остановить и собрать осадок.
По сравнению с этим ротор JA-10 может осадить частицы из 1,5 л жидкости за 5 мин, соответственно для центрифугирования 50 л нам потребуется 2 ч 47 мин. Т.е. ротор для проточного центрифугирования позволяет осаждать частицы, как минимум, в 8 раз быстрее, чем обычный ротор большого объема.
Проточные роторы, сердечники и их использование
 |
| Рис. 5. Ротор JCF-Z для проточного центрифугирования |
В настоящий момент компания Beckman Coulter предлагает два ротора для проточного центрифугирования: JCF-Z и CF-32 Ti.
Ротор JCF-Z используют на высокоскоростных центрифугах серии Avanti. Его максимальная скорость вращения составляет 20 000 об/мин.
Ротор JCF-Z можно использовать с 3 типами взаимозаменяемых сердечников для проточного центрифугирования (сердечник для стандартного осадка, сердечник для большого осадка, сердечник для малого осадка) и 2 типами сердечников для зонального центрифугирования (стандартный сердечник и сердечник с переориентацией градиента). В этом разделе мы будем обсуждать сердечники только для проточного центрифугирования. (На рис. 5 представлена фотография ротора JCF-Z, на рис. 6 – фотографии его сердечников).
Для ротора CF-32 Ti производится только один тип сердечников: для проточного центрифугирования. Максимальная скорость вращения – 32 000 об/мин. Ротор CF-32 Ti можно использовать на большинстве ультрацентрифуг серии Model L и на ультрацентрифугах серии Optima X.
Корпус и крышка роторов JCF-Z и CF-32 Ti сделаны из титана. Сердечники выполнены из пластика Noryl, который можно безопасно использовать с большинством растворов для создания градиентов и буферов. (Списки материалов, к которым устойчив пластик Noryl, представлены в руководствах пользователя роторов и центрифуг.)
Все сердечники, кроме сердечника JCF-Z для малого объема осадка, имеют коническую форму и 4 съемных перегородки из пластика Noryl, которые разделяют полость ротора на отсеки и стабилизируют жидкость внутри него во время вращения. Сердечник JCF-Z для малого объема осадка имеет 6 отдельных полостей, в которые устанавливаются контейнеры для сбора осадка.
Пространство между сердечником и корпусом определяет общую емкость ротора. Определенную часть этой емкости на периферии занимают осадок, градиент или подушка. Оставшаяся часть емкости, прилегающая к сердечнику, называется «объем, возникающий за счет скоса сердечника». Это область, через которую протекает исходный материал и в которой происходит осаждение на стенки ротора, градиент или подушку.
В Таблице 1 представлены спецификации различных комбинаций ротор-сердечник.
Проточный ротор JCF-Z
Ротор JCF-Z с сердечником для проточного центрифугирования подходит для осаждения бактерий, больших субклеточных частиц, таких как мембраны, митохондрии и т. д., вирусов и других частиц с коэффициентом седиментации больше 500 S. Его также используют для очистки вирусосодержащей культуральной среды от клеточного дебриса перед финальным сбором вируса путем осаждения или разделения в градиенте в том же самом роторе или роторе CF-32 Ti.
При вращении ротора JCF-Z с сердечником для стандартного осадка со скоростью 20 000 об/мин на дне сердечника развивается центробежное ускорение 32 000 g, а на внутренней поверхности стенок – 39 900 g. Скорость потока может лежать в диапазоне от 3 до 45 л/ч (вращающийся уплотнительный узел требует скорости потока не менее 3 л/ч). В случаях, когда высокая скорость потока более целесообразна, лучше использовать специальный уплотнительный узел, который рассчитан на перекачивание жидкости со скоростью до 100 л/ч.
Ротор JCF-Z можно использовать с некоторыми центрифугами серии Avanti. В случаях, когда контроль температуры образца критичен, следует заранее охлаждать сам ротор. Жидкости, которые будут прокачиваться через ротор, тоже должны быть холодными, поскольку они будут в некоторой степени нагреваться при прохождении по трубкам и через уплотнительный узел. Емкость с образцом следует хранить на льду или в охлаждающей водяной бане, а длина трубок должна быть максимально короткой.
Тип сердечника для ротора JCF-Z, который следует использовать, определяется количеством предполагаемого осадка и тем, есть ли необходимость разделения в градиенте или осаждения на подушку.
 |
| Рис. 6. Ротор JCF-Z для проточного центрифугирования и сердечники для него. |
 |
| Рис. 7. Ротор CF-32 Ti для проточного центрифугирования с сердечником. |
Сердечник для осадка большого объема подходит только для осаждения. Его общая емкость составляет 1 250 мл, из которых осадок может занимать 800 мл. Этот сердечник отлично подходит для центрифугирования жидкостей с большим содержанием частиц. Отношение количества твердых частиц к жидкости может достигать 1:2. Разумеется, это означает, что до момента, когда придется остановить центрифугу для разгрузки ротора, получится отцентрифугировать меньшее количество материала.
Сердечник для осадка малого объема также подходит только для осаждения. Его общая емкость составляет 240 мл, из которых осадок может занимать около 200 мл. Этот сердечник предназначен для центрифугирования большого количества материала с низким соотношением количества твердых частиц к жидкости (например, воды, содержащей водоросли или глинистые частицы). Чтобы минимизировать возможность ресуспендирования осажденного материала, сердечник имеет 6 отдельных отсеков, в каждый из которых вставляется контейнер в форме каноэ для сбора осадка.
Для ротора JCF-Z также выпускается 2 типа сердечников для зонального разделения: стандартный сердечник и сердечник с переориентацией градиента.
Проточный ротор CF-32 Ti
Ротор CF-32 Ti предназначен для концентрирования частиц, размеры которых лежат в широком диапазоне значений. Из-за высокой скорости вращения (до 32 000 об/мин) он особенно подходит для разделения вирусов или других маленьких частиц с коэффициентами седиментации около 50 S. При вращении с максимальной скоростью на дне сердечника развивается центробежное ускорение 86 100 g, а на внутренней поверхности стенок – 102 000 g. Скорость потока может достигать 9 л/ч.
Общая емкость ротора составляет 430 мл, из которых осадок может занимать около 330 мл. Если используется жидкостная подушка или ступенчатый градиент, каждый из которых будет занимать около 300 мл, места для осадка будет меньше.
Ультрацентрифуги, с которыми используется ротор CF-32 Ti, могут охлаждаться. Поскольку уплотнительный узел ротора CF-32 Ti имеет водяную рубашку из нержавеющей стали, нормальная температура этого элемента может поддерживаться при более низких скоростях потока, чем в роторе JCF-Z. До тех пор, пока не требуется температура 10°С и ниже, достаточно подводить к водяной рубашке водопроводную воду. В противном случае следует использовать водоохладитель с насосом, а исходный материал и ротор – охлаждать заранее.
Таблица 1. Роторы и сердечники Beckman Coulter для проточного центрифугирования.
| Характеристика | CF‑32‑Ti | JCF-Z | ||
| Станд. сердечник | Сердечник для осадка малого объема | Сердечник для осадка большого объема | ||
| Макс. скорость вращения ротора | 32 000 об/мин1 |
20 000 об/мин |
20 000 об/мин |
20 000 об/мин |
| Макс. центробежное ускорение на дне сердечника | 86 100 g | 32 000 g | 25 000 g | 23 000 g |
| Макс. центробежное ускорение в верхней части сердечника | 91 950 g | 34 000 g | 25 000 g | 25 000 g |
| Макс. центробежное ускорение на стенке ротора | 102 000 g | 39 900 g | 36 300 g | 39 900 g |
| Общая емкость ротора | 430 мл | 660 мл | 240 мл | 1 250 мл |
| Макс. объем осадка | 330 мл | 400 мл | 204 мл | 800 мл |
| Макс. скорость потока - Стандартный уплотнительный узел | 9 л/ч | 45 л/ч | 45 л/ч | 45 л/ч |
| Макс. скорость потока – Уплотнительный узел для высокой скорости | — | 100 л/ч | 100 л/ч | 100 л/ч |
| Макс. допустимая средняя плотность содержимого ротора при максимальной скорости2 | 1,20 г/мл | 1,45 г/мл | 1,45 г/мл | 1,45 г/мл |
| Допустимый диапазон pH растворов | 4-10 | 4-10 | 4-10 | 4-10 |
1После 1 000 запусков или 2 500 часов работы максимальную скорость центрифугирования в роторе CF-32 Ti следует снизить до 29 000 об/мин.
2Если плотность самой тяжелой фракции в градиенте превышает 1,20 г/мл для ротора CF-32 Ti или 1,45 г/мл для ротора JCF-Z, то максимально допустимая скорость центрифугирования будет ниже. Для ротора CF-32 Ti максимально допустимая скорость с поправкой определяется по формуле:


При формировании чрезвычайно тяжелого осадка, например, при центрифугировании жидкостей, содержащих металлические или глинистые частицы, максимально допустимая скорость тоже потребует внесения поправки.
Другие инструменты, необходимые для проточного центрифугирования
В дополнение к роторам JCF-Z или CF-32 Ti и соответствующим центрифугам понадобятся перечисленные ниже инструменты:
- Перистальтический насос, способный работать с противодавлением 138 кПа (20 psi); необходим для закачивания в ротор жидкостной подушки или ступенчатого градиента, а также исходного материала
- Манометр, который поможет проверить скорость потока между насосом и уплотнительным узлом.
- Проточный фотометр понадобится для мониторинга эффлюента на предмет эффективности осаждения и оценки разделения материала при извлечении из ротора жидкостной подушки и градиентного раствора.
- Входные и выходные трубки, имеющие такой же диаметр, как трубки ротора.
- Коллектор фракций.
- Емкости для образца и эффлюента.
- Аксессуары для охлаждения как на рис. 8 и 9.
 |
| Рис. 8.Установка для загрузки и извлечения жидкостной подушки или ступенчатого градиента. |
 |
| Рис. 9. Установка для проточного центрифугирования. |
Ответы на вопросы о проточном центрифугировании
| 1. | Мне часто бывает нужно осадить частицы из большого количества исходного материала, и я не уверен, какой ротор лучше использовать: для зонального или проточного центрифугирования. Какой из них лучше подойдет для моих целей? |
| Если вы успешно осаждали свои частицы с помощью обычного углового или бакетного ротора, с подушкой или без нее, то ротор для проточного центрифугирования позволит вам масштабировать этот процесс. То же самое можно сказать, если вы успешно проводили изопикническое разделение, в результате которого около интересующей вас полосы не было примесей.
Если вы хотите разделить на составляющие многокомпонентный образец, то будет лучше выбрать один из роторов для зонального центрифугирования. Хотя способность удерживать частицы у зональных роторов гораздо ниже (20–200 мл) по сравнению с роторами для проточного центрифугирования, она в 50–100 раз выше по сравнению с бакетными роторами. Если вы выделяли ваши частицы путем зонально-скоростного осаждения или если вам нужно определить коэффициент седиментации ваших частиц, вам также потребуется ротор для зонального центрифугирования. Роторы для проточного центрифугирования не подходят для зонально-скоростного центрифугирования. |
|
| 2. | Сейчас я использую для осаждения угловой ротор и хотел бы получать тот же результат методом проточного центрифугирования. Как мне определить подходящую скорость потока? |
| Для того чтобы определить необходимую скорость потока, вам нужно сначала рассчитать приблизительное значение коэффициента седиментации ваших частиц. Удовлетворительную грубую оценку можно сделать при помощи формулы:
s = k/t, где s – коэффициент седиментации в сведбергах, k – это k-фактор углового ротора, который сейчас используется (его значение вы сможете найти в руководстве для вашего ротора), t – время (в часах), за которое в вашем роторе формируется осадок. Если вы центрифугируете в вашем роторе при скорости меньшей максимально допустимой, то: s = (k/t) (максимальная скорость вращения/реальная скорость вращения).2 Рассчитанный коэффициент седиментации вы можете теперь использовать для определения скорости потока при помощи номограмм, представленных ниже. |
|
| 3. | Насколько критичны пузырьки воздуха в системе? |
| Пузырьки воздуха будут причиной высокого противодавления. При низких скоростях, например во время загрузки, это не проблема. Однако при рабочей скорости подъемная сила, действующая на пузырьки, преумножается относительной центробежной силой. Входящий поток образца не сможет сместить такой пузырек. Если давление выше 173 кПа (25 psi), выполните инструкции по удалению воздуха из системы, приведенные в руководстве пользователя. Возможно, между насосом и входом в ротор придется установить ловушку для пузырьков, которые могут появиться в образце из-за его дегазации. | |
| 4. | Как определить условия центрифугирования? |
| Условиями центрифугирования называют сочетание скорости центрифугирования и скорости потока. Если вы центрифугируете образец с очень маленькими частицами, то чтобы их осадить, нужно задать максимально возможную скорость вращения и минимальную скорость потока. В противном случае комбинаций скорость вращения/скорость потока может быть много, и каждая из них подходит для осаждения частиц определенного размера. Обычно скорость потока выбирают, исходя из количества образца, который нужно отцентрифугировать, и из того, как много времени вы можете на это потратить. Скорость вращения уже будет зависеть от выбранной скорости потока. | |
| 5. | Как много времени займет подготовка к проточному центрифугированию? |
| Опытный пользователь сможет подготовить оборудование за 30 минут, а разобрать – за 10 минут. | |
| 6. | Как извлечь образец из ротора? |
| Некоторые образцы, например бактерии или дрожжи, могут прилипать к стенкам ротора. В таком случае сначала при помощи большого шприца или отсоса отберите супернатант, а затем соскребите осадок. Если вы использовали сердечник JCF-Z для малого объема осадка, просто выньте контейнеры в форме каноэ и соскребите осадок. Другие образцы, например клеточные мембраны и клетки, не будут прилипать к стенкам, а будут формировать очень концентрированную кашицу. В этом случае чтобы получить осадок, необходимо будет выполнить дополнительное центрифугирование с помощью обычного ротора. | |
| 7. | Как следует очищать ротор после использования? |
| После каждого использования все части ротора, которые были в контакте с образцом, и уплотнительный узел следует промыть в растворе мягкого детергента, а затем в дистиллированной воде. Затем их следует высушить теплым воздухом. Все детали можно автоклавировать при температуре до 125°С, за исключением снимаемых перегородок из пластика Noryl и контейнеров в форме каноэ для малого объема осадка, которые при такой температуре могут деформироваться. Влага может сократить время жизни деталей ротора JCF-Z, поэтому при автоклавировании их следует поместить в паронепроницаемый контейнер. | |
| 8. | Как следует выполнять проточное центрифугирование патогенных материалов? |
| Во всех руководствах по эксплуатации роторов для проточного центрифугирования компании Beckman Coulter встречается следующее предупреждение: «Центрифугирование больших объемов патогенных материалов в этих роторах может привести к тому, что концентрация этих материалов окажется чрезвычайно высокой. Агенты, относительно безвредные в естественном разведенном состоянии, при концентрировании могут стать инфекционными. Необходимо точно оценить биологическую опасность центрифугируемых материалов и принять соответствующие меры предосторожности.» Для многих центрифуг предлагаются панели для удаленного контроля, а также HEPA-фильтры для размещения между вакуумной камерой и вакуумным насосом. Следует уделить внимание направлению воздушных потоков в помещении и посоветоваться со специалистом по технике безопасности. При исследовании очень опасных агентов следует работать в боксе биологической безопасности III класса на модифицированной центрифуге. Компания Beckman Coulter будет рада помочь вам в разработке подходящей системы. | |
| 9. | Как мне следует поступить, если я не уверен в нормальном состоянии своего ротора для проточного центрифугирования? |
| По заявкам пользователей компания Beckman Coulter, Inc. осуществляет проверку любых роторов. Если владелец ротора не уверен в его нормальном состоянии, ему следует воспользоваться данной услугой. | |
Хотите задать свой вопрос эксперту? Заполните форму обратной связи.
Примеры проточного центрифугирования
Ниже приведены ссылки на литературные источники с примерами типичного использования роторов CF-32 Ti и JCF-Z для проточного центрифугирования. В некоторых более ранних источниках упоминается ротор CF-35 Ti. В настоящее время он называется CF-32 Ti, и максимальная скорость его вращения составляет 32 000 об/мин. Ссылки сгруппированы по типу осаждаемого материала. Для каждой ссылки указан тип использованного ротора и способ центрифугирования.
Водоросли
Chlamydomonas reinhardtii JCF-Z, осаждение.
Schleicher M, Lukas TJ, Watterson DM. Isolation and characterization of calmodulin from the motile green alga Chlamydomonas reinhardtii. Arch. Biochem. Biophys. 229; 33–42: (1984).
Synechococcus cedrorum JCF-Z, осаждение.
Newman PJ, Sherman LA. Isolation and characterization of photosystem I and II membrane particles from the blue-green algae, Synechococcus cedrorum. Biochim. Biophys. Acta. 503; 343–361: (1978).
Бактерии
Acholeplasma laidlawii JCF-Z, осаждение.
Eriksson P-O, Rilfors L, Wieslander A, Lundberg A, Lindblom G. Order and dynamics in mixtures of membrane glucolipids from Acholeplasma laidlawii studied by 2H NMR. Biochemistry. 30; 4916–4924: (1991).
Bacillus licheniformis JCF-Z, осаждение.
Opheim D, Bernlohr RW. Purification and regulation of glucose-6-phosphate dehydrogenase from Bacillus licheniformis. J. Bacteriol. 116; 1150–1159: (1973).
Opheim D, Bernlohr RW. Purification and regulation of fructose-1, 6 bisphosphatase from Bacillus licheniformis. J. Biol. Chem. 250; 3024–3033: (1975).
Opheim DJ, Bernlohr RW. Fructose-1,6-bisphosphatase from Bacillus licheniformis. Methods in Enzymology. Vol. 90; pp. 384–391. Edited by WA Wood. New York, Academic Press, 1982.
Антигены Coxiella burneti JCF-Z, разделение в растворе сахорозы.
Leyk W, Krauss H. Zur Reinigung von Coxiella burneti- Antigen mittels Dichtegradienten-zentrifugation. Zentralbl. Bakteriol. Parasitenk. Infektionskr. Hyg., Abt. 1: Orig., Reihe A. 230; 508–517: (1975).
Escherichia coli JCF-Z, осаждение.
Meyers M, Blasi F, Bruni CB, Deeley RG, Kovach JS, Levinthal M, Mullinix KP, Vogel T, Goldberger RF. Specific binding of the first enzyme for histidine biosynthesis to the DNA of the histidine operon. Nucleic Acids Res. 2; 2021–2036: (1975).
Scherzer E, Auer B, Schweiger M. Identification, purification, and characterization of Escherichia coli virus T1 DNA methyl-transferase. J. Biol. Chem. 262; 15225–15231: (1987).
Wagenknecht T, Bloomfield VA. In vitro polymerization of bacteriophage T4D tail core subunits. J. Mol. Biol. 116; 347–359: (1977).
Zidwick MJ, Keller G, Rogers P. Regulation and coupling of argECBH mRNA and enzyme synthesis in cell extracts of Escherichia coli. J. Bacteriol. 159; 640–646: (1984).
Salmonella typhimurium JCF-Z, осаждение.
Robertson DE, Kroon PA, Ho C. Nuclear magnetic resonance and fluorescence studies of substrateinduced conformational changes of histidine-binding protein J of Salmonella typhimurium. Biochemistry. 16; 1443–1451; (1977).
Spirochetes JCF-Z, осаждение.
Livermore BP, Johnson RC. Lipids of the Spirochaetales: comparison of the lipids of several members of the genera Spirochaeta, Treponema, and Leptospira. J. Bacteriol. 120; 1268–1273: (1974).
Staphylococcus aureus JCF-Z, осаждение.
Peterson PK, Wilkinson BJ, Kim Y, Schmeling D, Douglas SD, Quie PG, Verhoef J. The key role of peptidoglycan in the opsonization of Staphylococcus aureus. J. Clin. Invest. 61; 597–609: (1978).
Streptococcus pyogenes JCF-Z, осветление культуральной жидкости.
Cunningham CM, Barsumian EL, Watson DW. Further purification of group A streptococcal pyrogenic exotoxin and characterization of the purified toxin. Infect. Immun. 14; 767–775: (1976).
Другие клетки
Acanthamoeba castellanii JCF-Z, осаждение.
Radebaugh CA, Matthews JL, Geiss GK, Liu F, Wong J-M, Bateman E, Camier S, Sentenac A, Paule MR. TATA box-binding protein (TBP) is a constituent of the polymerase I-specific transcription initiation factor TIF-1B (SL1) bound to the rRNA promoter and shows differential sensitivity to TBP-directed reagents in polymerase I, II, and III transcription factors. Mol. Cell. Biol. 14; 597–605: (1994).
Crithidia luculiae JCF-Z, осаждение.
Steenkamp DJ. The purine-2-deoxyribonucleosidase from Crithidia luculiae. Purification and trans-N-deoxyribosylase activity. Eur. J. Biochem. 197; 431–439: (1991).
Клетки Vero, зараженные вирусом JCF-Z, осаждение.
Barrett N, Mitterer A, Mundt W, Eibl J, Eibl M, Gallo RC, Moss B, Dorner F. Large-scale production and purification of a vaccinia recombinant-derived HIV-1 gp160 and analysis of its immunogenicity. AIDS Res. Hum. Retroviruses. 5; 159–173: (1989).
Среда для клеточных культур
Сыворотка телят CF-32 Ti, осветление.
Uckert W, Wunderlich V, Bender E, Sydow G, Bierwolf D. The protein pattern of PMF virus, a type-D retrovirus from malignant permanent human cell lines. Arch. Virol. 64; 155–166: (1980).
Среда для клеточных культур CF-32 Ti, осветление.
Henderson LE, Hewetson JF, Hopkins RF III, Sowder RC, Neubauer RH, Rabin H. A rapid, large scale purification procedure for gibbon interleukin 2. J. Immunol. 131; 810–815: (1983).
Iwata KK, Fryling CM, Knott WB, Todaro GJ. Isolation of tumor cell growth-inhibiting factors from a human rhabdomyosarcoma cell line. Cancer Res. 45; 2689– 2694: (1985).
Marquardt H, Todaro GJ. Human transforming growth factor. Production by a melanoma cell line, purification, and initial characterization. J. Biol. Chem. 257; 5220– 5225: (1982).
Marquardt H, Wilson GL, Todaro GJ. Isolation and characterization of a multiplication-stimulating activity (MSA)-like polypeptide produced by a human fibrosarcoma cell line. J. Biol. Chem. 255; 9177–9181: (1980).
Среда для клеточных культур JCF-Z, осветление.
Marquardt H, Wilson GL, Todaro GJ. Isolation and characterization of a multiplication-stimulating activity (MSA)-like polypeptide produced by a human fibrosarcoma cell line. J. Biol. Chem. 255; 9177–9181: (1980).
Прочее
Белки головного мозга и белковые преципитаты JCF-Z, осветление, осаждение.
Prusiner SB, McKinley MP, Bowman KA, Bolton DC, Bendheim PE, Groth DF, Glenner GG. Scrapie prions aggregate to form amyloid-like birefringent rods. Cell. 35; 349–358: (1983).
Преципитаты белков головного мозга JCF-Z, осаждение.
Turk E, Teplow DB, Hood LE, Prusiner SB. Purification and properties of the cellular and scrapie hamster prion proteins. Eur. J. Biochem. 176; 21–30: (1988).
Преципитаты, содержащие вирус скрейпи JCF-Z, осаждение.
Prusiner SB, McKinley MP, Bolton DC, Bowman KA, Groth DF, Cochran SP, Hennessey EM, Braunfeld MB, Baringer JR, Chatigny MA. Prions: methods for assay, purification, and characterization. Methods in Virology. Vol. 8; pp. 293–345. Edited by K Maramorosch and H Koprowski. Orlando, Academic Press, 1984.
Вода поверхностных слоев JCF-Z, очистка от частиц.
Reid PM, Wilkinson AE, Tipping E, Jones MN. Determination of molecular weights of humic substances by analytical (UV scanning) ultracentrifugation. Geochim. Cosmochim. Acta. 54; 131–138: (1990).
Субклеточные фракции
Гомогенат головного мозга JCF-Z, осветление.
Prusiner SB, McKinley MP, Bolton DC, Bowman KA, Groth DF, Cochran SP, Hennessey EM, Braunfeld MB, Baringer JR, Chatigny MA. Prions: methods for assay, purification, and characterization. Methods in Virology. Vol. 8; pp. 293–345. Edited by K Maramorosch and H Koprowski. Orlando, Academic Press, 1984.
Turk E, Teplow DB, Hood LE, Prusiner SB. Purification and properties of the cellular and scrapie hamster prion proteins. Eur. J. Biochem. 176; 21–30: (1988).
Щелевые контакты, печень крысыJCF-Z, осаждение.
Hertzberg EL, Gilula NB. Isolation and characterization of gap junctions from rat liver. J. Biol. Chem. 254; 2138– 2147: (1979).
Лизат, тромбоциты человека JCF-Z, осветление супернатанта.
Heldin C-H, Johnsson A, Ek B, Wennergren S, Rönnstrand L, Hammacher A, Faulders B, Wasteson A, Westermark B. Purification of human platelet-derived growth factor. Methods in Enzymology. Vol. 147; pp. 3–13. Edited by D Barnes. Orlando, Academic Press, 1987.
Мембраны, эритроциты человека JCF-Z, осаждение на подушку из раствора сахарозы.
Kahane I, Furthmayr H, Marchesi VT. Isolation of membrane glycoproteins by affinity chromatography in the presence of detergents. Biochim. Biophys. Acta. 426; 464–476; (1976).
Marchesi VT. Isolation of spectrin from erythrocyte membranes. Methods in Enzymology. Vol. 32; pp. 275– 277. Edited by S Fleischer and L Packer. New York, Academic Press, 1974.
Митохондрии, говяжья печень JCF-Z, осаждение.
Laipis PJ, Hauswirth WW, O’Brien TW, Michaels GS. A physical map of bovine mitochondrial DNA from a single animal. Biochim. Biophys. Acta. 565; 22–32: (1979).
Митихондрии, гриб JCF-Z, осаждение.
Brambl R. Mitochondrial biogenesis during fungal spore germination. Biosynthesis and assembly of cytochrome c oxidase in Botryodiplodia theobromae. J. Biol. Chem. 255; 7673–7680: (1980).
Josephson M, Brambl R. Mitochondrial biogenesis during fungal spore germination. Purification, properties and biosynthesis of cytochrome c oxidase from Botryodiplodia theobromae. Biochim. Biophys. Acta. 606; 125–137: (1980).
Ядра, телячья печень CF-32 Ti, разделение в градиенте плотности сахарозы.
Cacace MG, Nucci R, Reckert H. Large scale preparation of calf liver nuclei by continuous flow centrifugation. Experientia. 33; 855–857: (1977).
Плазматические мембраны, говяжья печень JCF-Z, осаждение.
Rosen P, Ehrich B, Junger E, Bubenzer HJ, Kühn L. Binding and degradation of insulin by plasma membranes from bovine liver isolated by a large scale preparation. Biochim. Biophys. Acta. 587; 593–605: (1979).
Плазматические мембраны, свинная печень JCF-Z, осаждение.
Meyer HE, Bubenzer H-J, Herbertz L, Kuehn L, Reinauer H. Purification of the insulin receptor protein from porcine liver membranes. Hoppe-Seyler’s Z. Physiol. Chem. 362; 1621–1629: (1981).
Плазматические мембраны, крысиная печень JCF-Z, осаждение.
Hertzberg EL. Isolation and characterization of liver gap junctions. Methods in Enzymology. Vol. 98; pp. 501– 510. Edited by S Fleischer and B Fleischer. New York, Academic Press, 1983.
Тканевой фильтрат, мышиная печень JCF-Z, осаждение.
Goodenough DA. Bulk isolation of mouse hepatocyte gap junctions. Characterization of the principal protein, connexin. J. Cell Biol. 61; 557–563: (1974).
Вирусы
Вирус диареи телят CF-32 Ti, разделение в растворе сахарозы.
Sharpee RI, Mebus CA, Bass EP. Characterization of a calf diarrheal coronavirus. Am. J. Vet. Res. 37; 1031– 1041: (1976).
Вирус Эпштейна-Барр JCF-Z, осветление культуральной жидкости, содержащей вирус; CF-32 Ti, осаждение.
Shibley GP, Manousos M, Munch K, Zelljadt I, Fisher L, Mayyasi S, Harewood K, Stevens R, Jensen KE. New method for large-scale growth and concentration of the Epstein-Barr viruses. Appl. Environ. Microbiol. 40; 1044–1048: (1980).
Вирус лейкемии кошек JCF-Z, осветление культуральной жидкости, содержащей вирус; CF-32 Ti, разделение в растворе сахарозы.
Hoekstra J, Deinhardt F. Simian sarcoma and feline leukemia virus antigens: isolation of species- and interspeciesspecific proteins. Intervirology. 2; 222–230: (1973–74).
Salerno RA, Larson VM, Phelps AH, Hilleman MR. Infection and immunization of cats with the Kawakami-Theilen strain of feline leukemia virus. Proc. Soc. Exp. Biol. Med. 160; 18–23: (1979).
Вирус лейкоза гиббонов CF-32 Ti, разделение в растворе сахарозы.
Harewood KR, Chang P, Higdon C, Larson D. The endogenous reverse transcriptase activity of gibbon ape lymphoma virus: characterization of the DNA product. Biochim. Biophys. Acta. 407; 14–23: (1975).
Вирус саркомы мышей Харви JCF-Z, осветление культуральной жидкости, содержащей вирус; CF-32 Ti, разделение в растворе сахарозы.
Parks WP, Scolnick EM. In vitro translation of Harvey murine sarcoma virus RNA. J. Virol. 22; 711–719: (1977).
Вирус гепатита A CF-32 Ti, осаждение.
Wheeler CM, Robertson BH, Van Nest G, Dina D, Bradley DW, Fields HA. Structure of the hepatitis A virion: peptide mapping of the capsid region. J. Virol. 58; 307–313: (1986).
Вирус гепатита B CF-32 Ti, разделение в растворе сахарозы.
Takahashi T, Nakagawa S, Hashimoto T, Takahashi K, Imai M, Miyakawa Y, Mayumi M. Large-scale isolation of Dane particles from plasma containing hepatitis B antigen and demonstration of a circular double-stranded DNA molecule extruding directly from their cores. J. Immunol. 177; 1392–1397: (1976).
Tsuda F, Takahashi T, Takahashi K, Miyakawa Y, Mayumi M. Determination of antibody to hepatitis B core antigen by means of immune adherence hemagglutination. J. Immunol. 115; 834–838: (1975).
Вирус гриппа CF-32 Ti, разделение в растворе сахарозы.
McAleer WJ, Hurni W, Wasmuth E, Hilleman MR. High resolution flow-zonal centrifuge system. Biotechnol. Bioeng. 21; 317–321: (1979).
Mistretta AP, Crovari-Cuneo P, Giacometti G, Sacchi G, Strozzi F. Purification and concentration of influenza inactivated viruses by continuous-flow zonal centrifugation. Boll. Ist. Sieroter. Milan. 54; 45–56: (1975).
Mountford CE, Grossman G, Hampson AW, Holmes KT. Influenza virus: an NMR study of mechanisms involved in infection. Biochim. Biophys. Acta. 720; 65–74: (1982).
Вирус C-типа млекопитающих CF-32 Ti, разделение в растворе сахарозы.
Olpin J, Oroszlan S, Gilden RV. Biophysical-immunological assay for ribonucleic acid type C viruses. Appl Microbiol. 28; 100–105: (1974).
Oroszlan S, Bova D, Huebner RJ, Gilden RV. Major groupspecific protein of rat type C viruses. J. Virol. 10; 746– 750: (1972).
Oroszlan S, Summers MR, Foreman C, Gilden RV. Murine type-C virus group-specific antigens: interstrain immunochemical, biophysical, and amino acid sequence differences. J. Virol. 14; 1559–1574: (1974).
Вирус мышиной саркомы Молони CF-35 Ti, осаждение на жидкостную подушку.
Gilden RV, Oroszlan S, Huebner RJ. Antigenic differentiation of M-MSV(O) from mouse, hamster, and cat C-type viruses. Virology. 43; 722–724: (1971).
Вирус опухоли молочной железы мышей CF-32 Ti, разделение в растворе сахарозы.
Drohan W, Kettmann R, Colcher D, Schlom J. Isolation of the mouse mammary tumor virus sequences not transmitted as germinal provirus in the C3H and RIII mouse strains. J. Virol. 21; 986–995: (1977).
Мышиный онкорнавирус CF-32 Ti, разделение в растворе сахарозы.
Burnette WN, Riggin CH, Mitchell WM. Physical and chemical properties of an oncornavirus associated with a murine adrenal carcinoma cell line. J. Virol. 14; 110–115: (1974).
Вирус лейкемии мышей CF -32 Ti, разделение в растворе сахарозы; JCF-Z, осветление культуральной жидкости, содержащей вирус.
Sherr CJ, Todaro GJ. Purification and assay of murine leukemia viruses. Methods in Enzymology. Vol. 58; pp. 412–424. Edited by WB Jakoby and IH Pastan. New York, Academic Press, 1979.
Вирус лейкемии мышей CF-32 Ti, разделение в растворе сахарозы.
Chattopadhyay SK, Hartley JW, Lander MR, Kramer BS, Rowe WP. Biochemical characterization of the amphotropic group of murine leukemia viruses. J. Virol. 26; 29–39: (1978).
Chattopadhyay SK, Jay G, Lander MR, Levine AS. Correlation of the induction of transcription of the AKR mouse genome by 5-iododeoxyuridine with the activation of an endogenous murine leukemia virus. Cancer Res. 39; 1539–1546: (1979).
Johnson PA, Rosner MR. Characterization of murinespecific leukemia virus receptor from L cells. J. Virol. 58; 900–908: (1986).
Levy RL, Lerner RA, Dixon FJ. Enhancement of infectivity and oncogenicity of a murine leukemia virus in adult mice by X-irradiation. Cancer Res. 36; 2090–2095: (1976).
Zwerner RK, Wise KS, Action RT. Harvesting the products of cell growth. Methods in Enzymology. Vol. 58; pp. 221–229. Edited by WB Jakoby and IH Pastan. New York, Academic Press, 1979.
Вирус лейкемии мышей Рашера JCF-Z, осветление культуральной жидкости, содержащей вирус.
Johnson RW, Perry A, Robinson OR Jr, Shibley GP. Method for reproducible large-volume production and purification of Rauscher murine leukemia virus. Appl. Environ. Microbiol. 31; 182–188: (1976).
Вирус RD114 CF-32 Ti, разделение в растворе сахарозы.
Okabe H, Gilden RV, Hatanaka M. RD114 virus-specific sequences in feline cellular RNA: detection and characterization. J. Virol. 12; 984–994: (1973).
Ретровирус CF-32 Ti, разделение в растворе сахарозы.
Faff O, Murray BA, Erfle V, Hehlmann R. Large scale production and purification of human retrovirus-like particles related to the mouse mammary tumor virus. FEMS Microbiol. Lett. 109; 289–296: (1993).
Uckert W, Sydow G, Hertline I, Rudolph M, Wunderlich V. Comparison of different methods for large volume concentration of a type D retrovirus (PMFV). Arch. Geschwulstforsch. 52; 541–549: (1982).
Ретровирус CF-32 Ti, осаждение.
Anderson KP, Low ML, Lie YS, Keller G-A, Dinowitz M. Endogenous origin of defective retroviruslike particles from a recombinant Chinese hamster ovary cell line. Virology. 181; 305–311: (1991).
Вирус саркомы обезьян 1 типа и ассоциированный вирус JCF-Z, осветление культуральной жидкости; CF-32 Ti, CF-35 Ti, разделение в растворе сахарозы.
Hoekstra J, Deinhardt F. Simian sarcoma and feline leukemia virus antigens: isolation of species- and interspeciesspecific proteins. Intervirology. 2; 222–230: (1973–74).
Jensik S, Hoekstra J, Silver S, Northrop RL, Deinhardt F. The 60 to 70S RNA and reverse transcriptase of simian sarcoma and simian sarcoma-associated viruses. Intervirology. 1; 229–241: (1973).
Вирус лихорадки Синдбис CF-32 Ti, разделение в растворе сахарозы.
von Bonsdorff C-H, Harrison SC. Hexagonal glycoprotein arrays from Sindbis virus membranes. J. Virol. 28; 578– 583: (1978).
Вирус осповакцины JCF-Z, разделение в растворе сахарозы.
Schwenen M, Richter KH. Isolierung von Vaccinia-Viren aus Tierhaut-Impfstoff. Eine vergleichende Untersuchung moderner Präparationsmethoden für die Impfstoffproduktion. II. Zonen-Zentrifugation im Sucrose-Dichtegradienten und Differentialzentrifugation. Zentralbl. Bakteriol. Parasitenk. Infektionskr. Hyg., Abt. 1: Orig., Reihe A. 228; 415–442: (1974).
Дрожжи
Saccharomyces carlsbergensis JCF-Z, осаждение.
El-Baradi TTAL, Raue HA, De Regt VCHF, Planta RJ. Stepwise dissociation of yeast 60S ribosomal subunits by LiCl and identification of L25 as a primary 26S rRNA binding protein. Eur. J. Biochem. 144; 393–400: (1984).
Saccaromyces cerevisiae JCF-Z, осаждение.
Kane PM, Yamashiro CT, Stevens TH. Biochemical characterization of the yeast vacuolar H+-ATPase. J.Biol. Chem. 264; 19236–19244: (1989).